Prevention of Bleeding in Patients with Atrial Fibrillation Undergoing PCI
N Engl J Med. 2016 Nov 14 [Epub ahead of print]
背景
PCIを行いステントを留置した心房細動合併患者では、ワーファリン+DAPTの標準的抗血栓療法によって血栓症と脳梗塞のリスクは減少するが、出血のリスクは増大する。リバーロキサバン+SAPTもしくはリバーロキサバン+DAPTの有効性と安全性は明らかではない。
方法
PCIを行った非弁膜症性心房細動の患者2124例を、以下の3群に1:1:1に無作為に割り付けた。
グループ1)低容量リバーロキサバン(15mg/日)+P2Y12阻害薬を12ヶ月内服
グループ2)超低容量リバーロキサバン(2.5mg/日)+DAPTを1・6・12ヶ月内服
グループ3)ワルファリン+DAPTを1・6・12ヶ月内服。
主要安全性評価項目は臨床的に重大な出血(TIMI出血基準で大出血、小出血、治療を要する出血)である。
結果
臨床的に重大な出血の発症率は、リバーロキサバンを内服している2群で、標準的抗血栓療法より低かった(グループ1:16.8%、グループ2:18.0%、グループ3:26.7%、グループ1vs3のハザード比0.59:95%CI0.47−0.76、グループ2vs3のハザード比0.63;95%CI0.50−0.80)。心血管死、心筋梗塞、脳梗塞の発症率は3群で似通っていた(グループ1:6.5%、グループ2:5.6%、グループ3:6.0%、いずれの群間比較でもP値は有意ではなかった)。
結論
PCIでステントを留置した心房細動患者では、12ヶ月の低容量リバーロキサバン+P2Y12阻害薬の内服、1・6・12ヶ月の超低容量リバーロキサバン+DAPTは、1・6・12ヶ月のワルファリン+DAPTの標準的抗血栓療法と比較し、臨床的に重大な出血が少なかった。3群の有効性に差はなかったが、信頼区間の幅は広い。
◇この論文のPICOはなにか
P:PCIを行なった非弁膜症性心房細動患者
I/C:以下の3群に1:1:1に割り付け
グループ1)低容量リバーロキサバン(15mg/日)+P2Y12阻害薬を12ヶ月内服
グループ2)超低容量リバーロキサバン(2.5mg/日)+DAPTを1・6・12ヶ月内服
グループ3)ワルファリン+DAPTを1・6・12ヶ月内服。
O:TIMI出血基準での臨床的に重大な出血(大出血+小出血+治療を要する出血)
inclusion criteria:18歳以上、発作性・持続性・慢性の非弁膜症性心房細動、1年以内に心房細動がドキュメントされていること、1年以内に心房細動がドキュメントされていなくてもPCIの3ヶ月前から抗凝固療法を行なっている場合
exclusion criteria:脳梗塞/TIAの既往、12ヶ月以内の重大な消化管出血、CCr<30ml/min、原因不明の貧血(Hb<10g/dl)、その他出血リスクがある患者
手順:PCIのシースを抜去72時間後にPT-INR2.5未満であれば無作為化を行う。無作為化の前にDAPT期間と使用するP2Y12阻害薬(クロピドグレル/プラスグレル/チカグレロル)を決めておき、それに応じて層別化を行う。
◇baselineは同等か
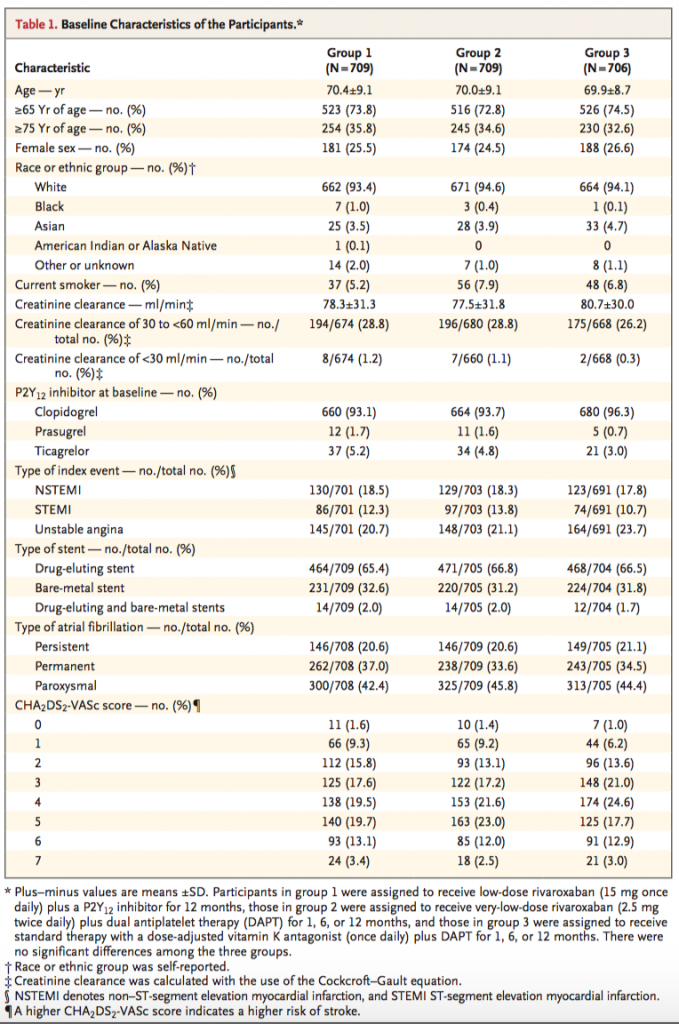
同等。平均70歳で、1/4が女性。ほとんどが白人。CCrは平均だと80ml/minぐらいで良いが、30−60ml/minも30%弱いる。ACSが半分。P2Y12阻害薬はほぼクロピドグレル。ステントは2/3がDESで、1/3がBMS。ワーファリンのTTRは65.0%とちょっと低め(治療域は2.0−3.0と設定)。CHA2DS2-VAScは平均で3−4ぐらい?
◇結果
地域:北米、南米、欧州など
登録期間:2013年3月〜2015年7月
観察期間:12ヶ月
無作為化:記載なし。
盲検化:オープンラベル。アウトカム評価者は盲検化されている。
必要症例数:記載なし。
症例数:2124例
追跡率:100%
解析:ITT解析
スポンサー:企業の関与あり(Janssen Scientific Affairs社、バイエル社)。リバーロキサバンは無料で提供。
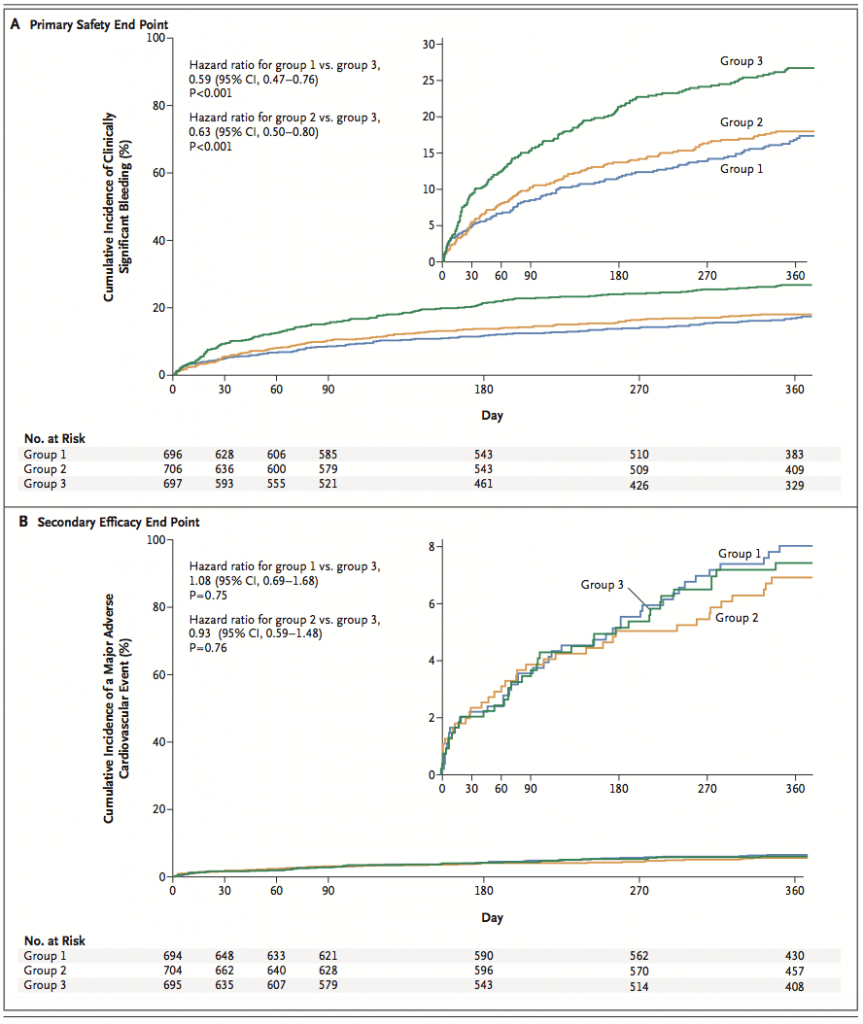
DAPT+ワルファリンが有意に出血が多い。
secondary efficacy endpointは心血管死、心筋梗塞、脳梗塞の複合エンドポイントで、有意な差はなかった。
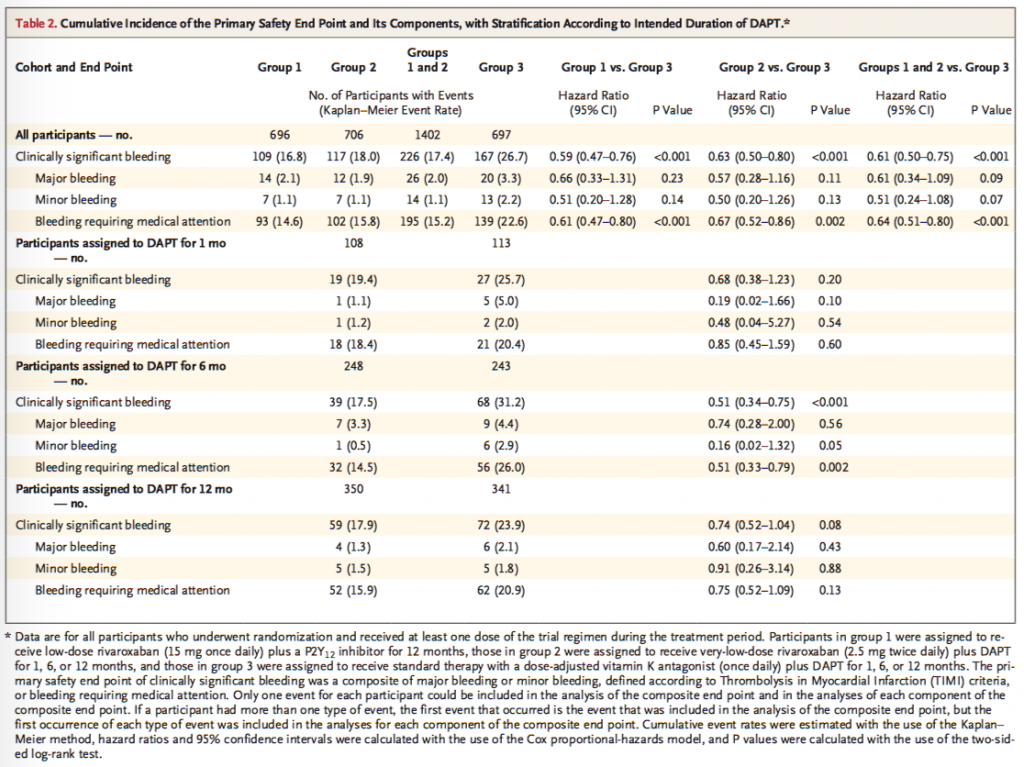
治療を要する出血(bleeding requiring medical attention)の定義がいまいちわからないけど、TIMI出血基準の小出血より軽度な出血のことらしい。大出血と小出血は、ワルファリン+DAPTが多い傾向だけど有意差はなくて、有意差がついているのは治療を要する出血という部分だけ。
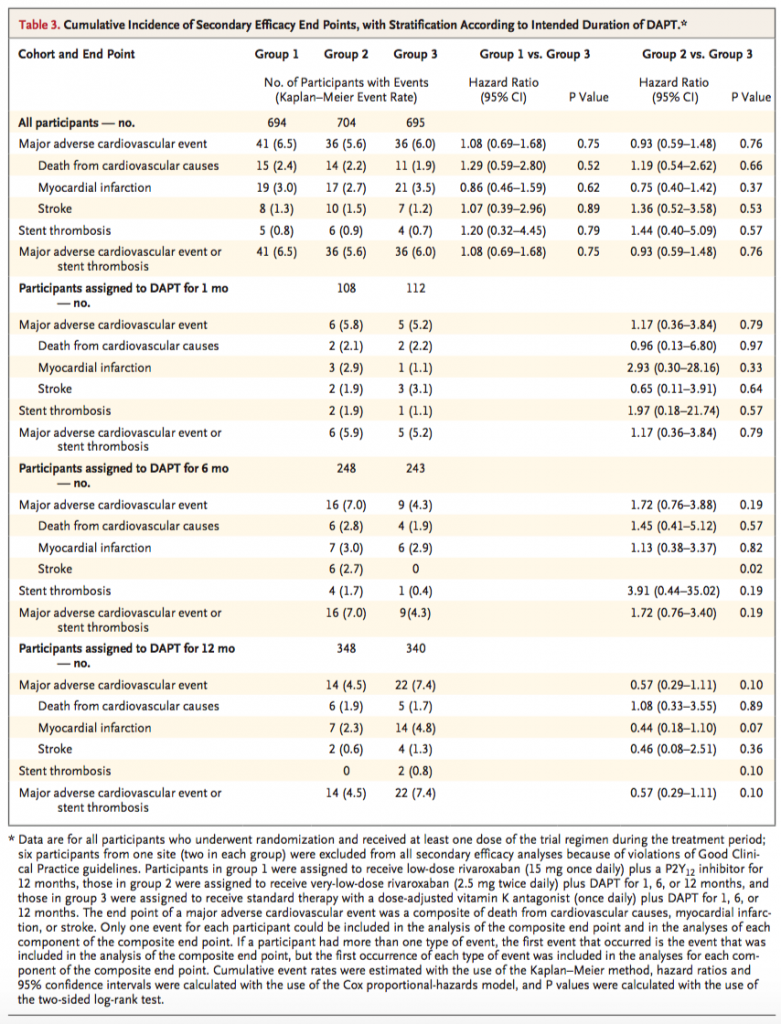
primary endpointの出血うんぬんより、個人的にはこっちの方が気になる。どれもイベント数が少なくて、有意な差はない。
◇批判的吟味
・primary endpointで有意差がついているが、その内訳をみると治療を要する出血(bleeding requiring medical attention)で有意差がついている。もちろん感覚的には納得できるが、これはソフトなエンドポイントであり、かつオープンラベルなので、バイアスが入るかもしれない。
・なぜ出血をprimary endpointにしているんだろう。梗塞+塞栓イベントをprimary endpointに設定して欲しかった。
・梗塞+塞栓イベントがsecondary outcomeに設定されているが、イベントの発生が少なくて本当に差があるのかどうかはわからない(3群とも同等と解釈してはいけない)。
・可能であれば、3−5年ぐらいの観察期間でsecondary outcomeがどうなっているか見てみたい。
・超低容量リバーロキサバン併用で塞栓イベントは増えないのか?
・日本だと低容量は10mg?、超低容量はどうすれば?
・ロストフォローアップはないが、どの群も20−30%で治療中断あり。
◇感想
PCIを行なった心房細動患者の抗血栓療法について結論はでていないが、WOEST試験の結果を踏まえて、抗血小板薬は単剤にしていることが多い(ACSなら最初は3剤)。それでもステント血栓症は経験してないので、抗血小板薬と抗凝固薬の2剤でいいんだろうなあという感触は持っています。
抗凝固薬はワルファリンじゃなくてNOACでいいのかわからないが、多くの場合にNOACを使っていると思われるし、自分もそうしている。このPIONEER AF-PCI試験は、NOAC+抗血小板薬でもいいのか検証した試験で、結果としてはワルファリン+DAPTよりも出血は有意に少なく、心血管死、心筋梗塞、脳梗塞は増えなかった。
それにしても、なんで出血がprimary endpointになっているんでしょうか。個人的には、むしろNOAC+抗血小板薬の2剤にすることで、梗塞や塞栓が増えないかが知りたかったので、secondary endpointに設定されている心血管死、心筋梗塞、脳梗塞を、primary endpointでやってほしかった。それだと、Nがでかくなりすぎるので難しいのでしょう。
あと、グループ2でATLAS ACS 2-TIMI51試験のレジメンを持ってきているが、この超低容量で塞栓イベントが増えないのかも気になる。
secondary endpointの心血管死、心筋梗塞、脳梗塞はイベント数が少なく、本当に差があるかどうかがわからない。これはもっと長い期間観察しないとわからないと思うので、3−5年のデータがでてくるといいなあと思いますが、1年以降の抗血栓療法をどのようにするかにもよるでしょう。
まあとりあえず、ルーチンで3剤飲まないといけないということはなさそうなので、今の感じの抗血栓療法(NOAC+P2Y12阻害薬の2剤で、ときどき3剤)でよさそうです。

